Бензойная кислота
Содержание:
Production
Industrial preparations
Benzoic acid is produced commercially by partial oxidation of toluene with oxygen. The process is catalyzed by cobalt or manganese naphthenates. The process uses cheap raw materials, proceeds in high yield, and is considered environmentally attractive.
U.S. production capacity is estimated to be 126 000 tonnes per year, much of which is consumed domestically to prepare other industrial chemicals.
Historical preparations
The first industrial process involved the reaction of benzotrichloride (trichloromethyl benzene) with calcium hydroxide in water, using iron or iron salts as catalyst. The resulting calcium benzoate is converted to benzoic acid with hydrochloric acid. The product contains significant amounts of chlorinated benzoic acid derivatives. For this reason, benzoic acid for human consumption was obtained by dry distillation of gum benzoin. Even after the discovery of other synthesis methods, it was forbidden to use benzoic acid of other source than gum benzoin.
Alkyl substituted benzene derivatives give benzoic acid with the stoichiometric oxidants potassium permanganate, chromium trioxide, nitric acid.
Общая информация
С точки зрения химии добавка Е-210 — это карбоновая кислота, относящаяся к классу простейших одноосновных кислот ароматического ряда. Химическая формула бензойной кислоты: C7H6O2 (C6H5COOH).
С физической точки зрения бензойная кислота представляет собой кристаллический порошок белого цвета с характерным запахом. Добавка Е-210 плохо растворима в воде, из-за чего вместо бензойной кислоты чаще всего применяется бензоат натрия (пищевая добавка E-211). В то же время добавка Е-210 достаточно хорошо растворима в диэтиловом эфире и этаноле.
Впервые бензойная кислота была получена методом сублимации в 16 веке из росного ладана (бензойной смолы). Отсюда бензойная кислота и получила своё название. В 1832 году немецким химиком Юстусом фон Либихом была определена структура бензойной кислоты, а также исследованы ее свойства и связь с гиппуровой кислотой. В 1875 были обнаружены и изучены антигрибковые свойства бензойной кислоты, в результате чего она долгое время применялась при консервировании фруктов.
В промышленности добавку Е-210 получают методом окислением толуола (метилбензола) при участии катализаторов. Этот процесс использует дешевое сырье и считается экологически чистым.
Бензойная кислота хорошо всасывается организмом человека и в виде гиппуровой кислоты (взаимодействуя с белковыми соединениями) выводится через почки. Существуют обоснованные опасения, что пищевые добавки Е-210 и E-211 могут вступать в безалкогольных напитках в реакции с аскорбиновой кислотой (витамин С, добавка E-300) с образованием свободного бензола, который является сильным канцерогеном. Поэтому рекомендуется избегать употребления напитков, в которых содержаться эти добавки одновременно.
Структура бензойной кислоты
На верхнем изображении структура бензойной кислоты представлена в виде стержня и сферы. Если подсчитать количество черных сфер, то будет проверено, что их шесть, то есть шесть атомов углерода; две красные сферы соответствуют двум атомам кислорода карбоксильной группы -COOH; и, наконец, белые сферы являются атомами водорода.
Как видно, ароматическое кольцо слева, ароматичность которого показана пунктирными линиями в центре кольца. А справа группа -COOH, ответственная за кислотные свойства этого соединения.
Молекулярно, С6H5COOH имеет плоскую структуру, потому что все его атомы (кроме водорода) имеют sp-гибридизацию2.
С другой стороны, группа -COOH, очень полярная, позволяет постоянному диполю существовать в структуре; диполь, который можно наблюдать с первого взгляда, если доступна его карта электростатического потенциала.
Этот факт как следствие того, что C6H5COOH может взаимодействовать с самим собой диполь-дипольными силами; в частности, со специальными водородными мостиками.
Если наблюдается группа -COOH, будет обнаружено, что кислород C = O может принимать водородную связь; в то время как кислород O-H дарит им.
Хрустальные и водородные мосты
Бензойная кислота может образовывать две водородные связи: она получает и принимает одну одновременно. Следовательно, он образует димеры; то есть его молекула «связана» с другим.
Являются ли эти пары или димеры, C6H5COOH-HOOCC6H5, структурная основа, которая определяет твердое тело в результате его упорядочения в пространстве.
Эти димеры образуют плоскость молекул, которые, благодаря своим сильным и направленным взаимодействиям, способны установить упорядоченную структуру в твердом теле. Ароматические кольца также участвуют в этой договоренности через взаимодействия дисперсионных сил.
В результате молекулы образуют моноклинный кристалл, точные структурные характеристики которого можно изучить с помощью инструментальных методов, таких как дифракция рентгеновских лучей..
Тогда пара плоских молекул может быть размещена в пространстве преимущественно водородными связями, чтобы вызвать появление этих белых и кристаллических игл..
Влияние на здоровье
При попадании в организм бензойная кислота реагирует с белковыми молекулами, превращаясь в N – бензоилглицин (гиппуровую кислоту). После трансформации соединение выводится с мочой. Данный процесс «нагружает» выделительную систему человека, поэтому во избежание нанесения вреда здоровью, законодательством каждого государства установлена допустимая норма применения кислоты при изготовлении продуктов питания. Сегодня разрешается использовать до 5 мг вещества на 1 кг готовой продукции. Превышение допустимого показателя преследуется законом и накладывает запрет на продажу таких изделий.
Вред бензойной кислоты заключается не только в увеличении нагрузки на почки. Она является «прародителем» опасного канцерогенного вещества: из неё может образовываться бензол в чистом виде, который провоцирует рост злокачественных новообразований. Для превращения кислоты в яд нужна очень высокая температура.
Выделение бензола в организме человека из бензойного соединения невозможно. Однако, нагревать не предназначенные для этого консервированные продукты, а затем их есть, не рекомендуется, поскольку это может привести к пищевому отравлению.
Помните, консервант Е210 даже в мизерном количестве (до 0,01 мг) губительно влияет на домашних питомцев: подрывает здоровье, ухудшает самочувствие. Поэтому прежде, чем кормить любимца, убедитесь, что в состав продукта не входит бензойная кислота, иначе последствия могут быть крайне трагичными.
Активность соединения падает в присутствии глицерина, белков, неионных ПАВ. При попадании на поверхность кожи вызывает покраснение и раздражение, вдыхании аэрозоля – тошноту, рвоту, судорожный кашель, насморк. Поэтому при работе с веществом и его солями используйте индивидуальные средства защиты (резиновые перчатки, спецодежду, противопылевые респираторы), соблюдайте меры личной гигиены.
Одновременный прием продуктов, богатых аскорбиновой и бензойной кислотами, приводит к образованию токсичного свободного бензола. Поэтому минимальный перерыв между приемами таких изделий (безалкогольных напитков и цитрусовых) составляет два часа.
Общая характеристика Benzoic acid
Benzoic acid (Бензойд Эйсид — C7H6O2 (or C6H5COOH)) – это бензойная кислота, а так же её многочисленные эфиры, которые великолепно чувствуют себя в эфирных маслах, в бальзамах, производная от бензойной смолы.
Впервые бензойная кислота была получена в 16 столетии из росного ладана путем возгонки. Спустя 3 века ученый Юстус фон Либих смог выявить структуру бензойной кислоты. Тогда же, в 19 веке вместе с другими немецкими химиками ему удалось установить немало сходств между свойствами бензойной кислоты и гиппуровой кислоты. Уже в 20 столетии бензойную кислоту стали активно использовать как пищевой консервант при изготовлении различных продуктов питания. Основанием для этого стали некоторые полезные свойства кислота, а именно – противомикробное и противогрибковое.
В настоящее время Benzoic acid производится окислением толуола с использованием катализаторов. Несколько ранее ее получали из фталевой кислоты или бензотрихлорида, но от этого способа было решено отказаться в дороговизны, да и технологический процесс был слишком сложным. Кроме этого кислоту можно встретить в природе в некоторых ягодах, таких как клюква, малина или брусника, а также в чае, анисе, вишневом дереве и коре акакии.
Бензойная кислота представляет собой белое кристаллическое вещество. По своей форме она напоминает тонкие длинные листочки либо же иголочки, блестящие при попадании солнечных лучей либо света лампы. Она с легкостью растворяется в разных веществах, будь то обычная вода, жир или спирт. Кроме того, бензойная кислота имеет свойство расплавляться и переходить в газообразное состояние. Происходит это при температуре ее нагревания 122 градуса по Цельсию.
Бензоаты (эфиры и соли бензойной кислоты) активно используют в пищевой промышленности, как пищевые консерванты (например: Е-210, Е-211, Е-212, Е-213). Обусловлено это лёгкостью и легкодоступностью производства консерванта. Их основное преимущество – подавление роста некоторых видов грибков, дрожжей и бактерий. В рамках законодательства применение этой кислоты допустимо – 0,05 до 0,1 %. И не более.
Применение полезных свойств Benzoic acid
В косметике
Для косметических целей C7H6O2 производится, практически всегда, синтетическим путём. Основная роль добавки – консервант, подавление роста бактерий, увеличение срока годности товара. Но по международным стандартам производитель обязан указывать лишь 40% всех ингредиентов, входящих в состав вашей парфюмированой баночки в косметичке. И, скорее всего, о бензойной кислоте в составе вас предупредят, но довольно отдалённо – не указывая явного процентного соотношения.
Если говорить, в каких косметических средствах используется бензойная кислота, то первым делом нужно обратить внимание на крема, лосьоны и скрабы для проблемной кожи. Обладая свойством активной борьбы с микробами, кислота в составе этих косметических средств поможет избавиться от прыщей и покраснений на лице и на других частях тела
Также она применяется для отбеливания кожи, удаления пигментных пятен и веснушек.
В пищевой промышленности
В пищевой промышленности используется антимикробное свойство бензойной кислоты. Так увидеть ее можно в составе таких продуктов, как соусы, кетчуп, ягодные и овощные консервы, рыбные продукты, алкогольные и безалкогольные напитки.
В медицине
Бензойная кислота активно борется с грибком и различными микробами, поэтому ее часто используют в медицине при изготовлении препаратов для лечения грибка кожи и некоторых лишайных заболеваний.
Безопасность и метаболизм млекопитающих [ править ]
Выводится в виде гиппуровой кислоты . Бензойная кислота метаболизируется бутират-КоА-лигазой в промежуточный продукт, бензоил-КоА , который затем метаболизируется глицин- N- ацилтрансферазой в гиппуровую кислоту. Люди метаболизируют толуол и бензойную кислоту, которая выделяется в виде гиппуровой кислоты .
Для людей, то Всемирная организация здравоохранения «s Международная программа по химической безопасности (МПХБ) предлагает временное терпимого потребления будет 5 мг / кг массы тела в сутки. Кошки имеют значительно более низкую толерантность к бензойной кислоте и ее солям, чем крысы и мыши . Смертельная доза для кошек может составлять всего 300 мг / кг массы тела. Оральная LD 50 для крыс составляет 3040 мг / кг, для мышей — 1940–2263 мг / кг.
В Тайбэе , Тайвань, исследование состояния здоровья города в 2010 году показало, что 30% сушеных и маринованных пищевых продуктов содержат бензойную кислоту.
Соли бензойной кислоты
Рассмотрим какие бывают бензоаты, их свойства и применение:
- Бензоат аммония. Представляет собой неорганическое соединение бензойной кислоты и соли аммония. Не имеет цвета, хорошо растворяется в этаноле, воде. Структурная формула – NH4(C6H5COO). Используется как антисептик (предупреждает процессы разложения на поверхности открытых ран), консервант в пищевой промышленности для увеличения срока годности продуктов, стабилизатора при изготовлении клеев, латексов и ингибитора коррозии.
- Бензоат лития. Это белая кристаллическая соль лития и бензойной кислоты. Химическая формула соединения – C6H5 – COOLi. Имеет сладковатый вкус, без запаха, растворяется в воде. Используется в фармакологии как нормотимическое средство для нормализации психического состояния. Оказывает антиманиакальное, седативное, антидепрессивное действие. Данный эффект обусловлен тем, что ионы лития вытесняют из клеток ионы натрия, снижая биоэлектрическую активность нейронов мозга. В результате падает уровень серотонина в тканях, концентрация норэпинефрина, повышается чувствительность нейронов гиппокампа к действию допамина. В терапевтических концентрациях снижает концентрацию нейронального инозита и блокирует активность инозил –1–фосфатазы.
- Бензоат натрия. Выступает пищевой добавкой, зафиксирована под кодом Е211, относится к группе консервантов. Структурная формула – C6H5COONa. Натриевая соль бензойной кислоты имеет характерный неярко выраженный запах бензальдегида, белый цвет. Консервант угнетает рост плесневых грибов, включая афлатоксинобразующие, дрожжей и снижает активность ферментов, расщепляющих крахмал, триглицериды.
Лучшие материалы месяца
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
В натуральных продуктах бензоат натрия содержится в яблоках, горчице, изюме, клюкве, корице. Применяется для консервирования плодово-ягодных, рыбных, мясных изделий, сладких газированных напитков. Входит в состав отхаркивающих средств, косметической продукции.
Помните, бензоат натрия может нарушать область ДНК в митохондриях и вызывать нейродегенеративные заболевания, болезнь Паркинсона, цирроз печени. Поэтому применение добавки Е211, из-за небезопасности для здоровья человека, в последние годы стремительно сокращается.
Таким образом, бензойная кислота и ее соли – органические добавки, используемые в пищевой, фармакологической, авиационной промышленностях и косметологии в качестве консерванта. Для сохранения здоровья употреблять продукты, содержащие Е210, нужно строго в умеренном количестве. Безопасная доза составляет 5 мг вещества на килограмм веса. Иначе перенасыщение организма бензойной кислотой может вызвать аллергические реакции, поражение нервной системы.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Тедеева Мадина Елкановна
Специальность: терапевт, врач-рентгенолог, диетолог.
Общий стаж: 20 лет.
Место работы: ООО “СЛ Медикал Груп” г. Майкоп.
Образование: 1990-1996, Северо-Осетинская государственная медицинская академия.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Производные
- 2,3-дигидроксибензойная кислота (пирокатехиновая кислота)
- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
- 2,5-дигидроксибензойная кислота (гентизиновая кислота)
- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
- 3,4-дигидроксибензойная кислота (протокатехиновая кислота)
- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли
Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Средства для волос
Использование производителями benzoic acid в косметике для волос должно сопровождаться указанием мер предосторожности. Если при мытье головы шампунем на кожу попадает ничтожно малое количество Е210, то при создании прически вдыхается критическое ее количество с парами лака для волос
Аэрозольные смеси имеют маленькую каплю, вследствие чего долго находятся во взвешенном состоянии. Характерный запах парикмахерской во многом обусловлен средствами для укладки. При несоблюдении правил использования и количества лака, распыленного на волосы, раздражаются дыхательные пути, что при постоянном воздействии может привести к аллергической астме.
Laboratory preparations
Benzoic acid is cheap and readily available, so the laboratory synthesis of benzoic acid is mainly practiced for its pedogical value. It is a common undergraduate preparation and an unusual feature of the compound is that its melting point equals its molecular weight (122). For all syntheses, benzoic acid can be purified by recrystallization from water owing to its high solubility in hot and poor solubility in cold water. The avoidance of organic solvents for the recrystallization makes this experiment particularly safe.
By hydrolysis
Like any other nitrile or amide, benzonitrile and benzamide can be hydrolyzed to benzoic acid or its conjugate base in acid or basic conditions.
From benzaldehyde
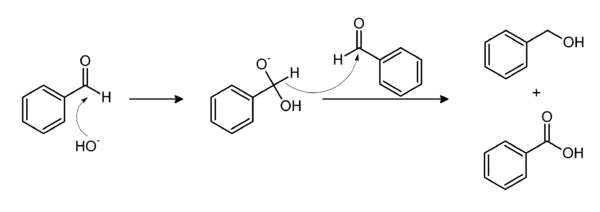
The base-induced disproportionation of benzaldehyde, the Cannizzaro reaction, affords equal amounts of benzoate and benzyl alcohol; the latter can be removed by distillation.
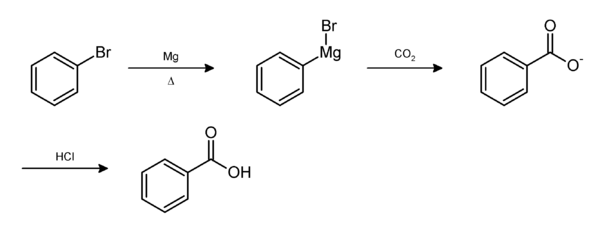
From bromobenzene
Bromobenzene in diethyl ether is stirred with magnesium turnings to produce phenylmagnesium bromide (C6H5MgBr). This Grignard reagent is slowly added to dry ice (solid carbon dioxide) to give benzoate. Dilute acid is added to form benzoic acid.
From benzyl alcohol
Benzyl alcohol is refluxed with potassium permanganate or other oxidizing reagents in water. The mixture hot filtered to remove manganese oxide and then allowed to cool to afford benzoic acid.
Использование шампуня
Химический состав шампуня может быть различным. Часто список ингредиентов шампуня занимает несколько абзацев.
У нас у всех разные волосы — длинные или короткие, густые или редкие, прямые или вьющиеся. И мы хотим подобрать шампунь, который подойдет к нашему типу волос и улучшит их состояние и внешний вид. И тут производители шампуней радостно идут нам навстречу и обещают мгновенное преображение волос. Только купите шампунь, и Ваши волосы станут сильными и блестящими, густыми и объемными.
Интересно, что волосы, и правда, преображаются после первого мытья, блестят, легко укладываются. И мы радуемся, не задумываясь, что вызывает такое преображение, долго ли оно продержится, и чем мы можем поплатиться за чудодейственный эффект. Ведь, если человек курил, неправильно питался, испытывал стресс и этим довел свои волосы до плачевного состояния, нужно или менять образ жизни и менять состояние волос изнутри, или использовать ударную дозу неких химических субстанций, которые быстро изменят волосы и неизвестно как повлияют на здоровье.
Если бы мы задумывались, что за быстрый внешний эффект мы расплатимся болезнями, то не спешили бы верить рекламе и сметать с полок шампуни.
Давайте читать состав шампуней на упаковке и выяснять, что может принести больше вреда, чем пользы.
Пусть Вас как покупателя не вводит в заблуждение информация о том, что шампунь прошел дерматологический контроль. Действительно, большинство продукции проходит проверку на количество токсичных компонентов. Содержание таких вредных веществ в шампунях как свинец, ртуть, мышьяк и других должно не превышать допустимую норму.
Однако нормы вредных веществ различаются в разных странах. Шампунь с одним и тем же названием, выпущенный в Европе, будет отличаться по составу от сделанного в Китае или Индии.
Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
