Конвертация единиц измерения концентрации
Содержание:
- Связанные количества
- Таблица конвертации EC в TDS/ppm
- Вычисление массовой доли спиртов в смеси этанола и метанола
- Растворимость. Коэффициент растворимости
- Примеры решения задач
- Задачи для самостоятельного решения
- Получение объема раствора с молярной концентрацией эквивалента
- Состав парфюмерии
- Формулы для пересчета концентраций растворов
- ПРИЛОЖЕНИЕ 1 (обязательное)
- Eau de cologne
Связанные количества
Числовая концентрация
Преобразование в числовую концентрацию дается выражением
Cя{\ displaystyle C_ {i}}
- Cязнак равноcяNА,{\ displaystyle C_ {i} = c_ {i} N _ {\ text {A}},}
где — постоянная Авогадро .
NА{\ displaystyle N _ {\ text {A}}}
Массовая концентрация
Преобразование в массовую концентрацию дается выражением
ρя{\ displaystyle \ rho _ {я}}
- ρязнак равноcяMя,{\ displaystyle \ rho _ {i} = c_ {i} M_ {i},}
где — молярная масса компонента .
Mя{\ displaystyle M_ {i}}я{\ displaystyle i}
Мольная доля
Преобразование в мольную долю дается выражением
Икся{\ displaystyle x_ {i}}
- Иксязнак равноcяM¯ρ,{\ displaystyle x_ {i} = c_ {i} {\ frac {\ overline {M}} {\ rho}},}
где — средняя молярная масса раствора, — плотность раствора.
M¯{\ displaystyle {\ overline {M}}}ρ{\ displaystyle \ rho}
Более простое соотношение можно получить, рассматривая общую молярную концентрацию, а именно сумму молярных концентраций всех компонентов смеси:
- Иксязнак равноcяcзнак равноcя∑jcj.{\ displaystyle x_ {i} = {\ frac {c_ {i}} {c}} = {\ frac {c_ {i}} {\ sum _ {j} c_ {j}}}.}
Массовая доля
Преобразование в массовую долю дается выражением
шя{\ displaystyle w_ {i}}
- шязнак равноcяMяρ.{\ displaystyle w_ {i} = c_ {i} {\ frac {M_ {i}} {\ rho}}.}
Моляльность
Для бинарных смесей преобразование в моляльность равно
б2{\ displaystyle b_ {2}}
- б2знак равноc2ρ-c1M1,{\ displaystyle b_ {2} = {\ frac {c_ {2}} {\ rho -c_ {1} M_ {1}}},}
где растворитель — это вещество 1, а растворенное вещество — это вещество 2.
Для растворов с более чем одним растворенным веществом преобразование равно
- бязнак равноcяρ-∑j≠яcjMj.{\ displaystyle b_ {i} = {\ frac {c_ {i}} {\ rho — \ sum _ {j \ neq i} c_ {j} M_ {j}}}.}
Таблица конвертации EC в TDS/ppm
| EC(mS/cm) | TDSАмериканский | TDSЕвропейский | TDSАвстралийский |
|---|---|---|---|
| EC 0.1 | 50 ppm | 64 ppm | 70 ppm |
| EC 0.2 | 100 ppm | 128 ppm | 140 ppm |
| EC 0.3 | 150 ppm | 192 ppm | 210 ppm |
| EC 0.4 | 200 ppm | 256 ppm | 280 ppm |
| EC 0.5 | 250 ppm | 320 ppm | 350 ppm |
| EC 0.6 | 300 ppm | 384 ppm | 420 ppm |
| EC 0.7 | 350 ppm | 448 ppm | 490 ppm |
| EC 0.8 | 400 ppm | 512 ppm | 560 ppm |
| EC 0.9 | 450 ppm | 576 ppm | 630 ppm |
| EC 1.0 | 500 ppm | 640 ppm | 700 ppm |
| EC 1.1 | 550 ppm | 704 ppm | 770 ppm |
| EC 1.2 | 600 ppm | 768 ppm | 840 ppm |
| EC 1.3 | 650 ppm | 832 ppm | 910 ppm |
| EC 1.4 | 700 ppm | 896 ppm | 980 ppm |
| EC 1.5 | 750 ppm | 960 ppm | 1050 ppm |
| EC 1.6 | 800 ppm | 1024 ppm | 1120 ppm |
| EC 1.7 | 850 ppm | 1088 ppm | 1190 ppm |
| EC 1.8 | 900 ppm | 1152 ppm | 1260 ppm |
| EC 1.9 | 950 ppm | 1216 ppm | 1330 ppm |
| EC 2.0 | 1000 ppm | 1280 ppm | 1400 ppm |
| EC 2.1 | 1050 ppm | 1334 ppm | 1470 ppm |
| EC 2.2 | 1100 ppm | 1408 ppm | 1540 ppm |
| EC 2.3 | 1150 ppm | 1472 ppm | 1610 ppm |
| EC 2.4 | 1200 ppm | 1536 ppm | 1680 ppm |
| EC 2.5 | 1250 ppm | 1600 ppm | 1750 ppm |
| EC 2.6 | 1300 ppm | 1664 ppm | 1820 ppm |
| EC 2.7 | 1350 ppm | 1728 ppm | 1890 ppm |
| EC 2.8 | 1400 ppm | 1792 ppm | 1960 ppm |
| EC 2.9 | 1450 ppm | 1856 ppm | 2030 ppm |
| EC 3.0 | 1500 ppm | 1920 ppm | 2100 ppm |
Вычисление массовой доли спиртов в смеси этанола и метанола
Задача 189.
Для окисления смеси этанола и метанола в кислой среде потребовалось добавить 0,64 моль перманганата калия и при этом выделилось 8,96 л. газа. Вычислите массовые доли спиртов в исходной смеси.Решение:
1. Процессы окисления спиртов протекают по-разному:
5С₂H₅OH + 4KMnO₄ + 6H₂SO₄ = 5CH₃COOH + 4MnSO₄ + 2K2SO4 + 11H₂O5СH₃OH + 6KMnO₄ + 9H₂SO₄ = 5CО₂ + 6MnSO₄ + 3K₂SO4 + 19H₂O
2. Определим количество вещества СО2, образовавшегося при окислении метанола, получим:
n(СО2) = V(СО2)/Vm(СО2) = 8,96 л/22,4 л/моль = 0,4 моль.n(СH₃OH) = n(СО2) = 0,4 моль.m(СH₃OH) = 32 г/моль • 0,4 = 12,8 г.
3. Определим количество вещества KMnO₄, затраченное на окисление метанола получим:
n1(KMnO4) = 6/5n(СО2) = 1,2•0,4 = 0,48 моль.
4. Определим количество вещества KMnO₄, затраченное на окисление этанола получим:
n2(KMnO4) = n(KMnO4) — n1(KMnO4) = 0,64 — 0,48 = 0,16 моль.
Тогда
n(С₂H₅OH) = 5/4n(KMnO4) = 1,25 • 0,16 = 0,2 моль.
m(С₂H₅OH) = 46 г/моль • 0,2 = 9,2 г.
Отсюда
m(смеси) = 12,8 + 9,2 = + 22 г.
5. Вычислим массовые доли веществ, получим:
w%(СH₃OH) = /m(смеси) = (9,2 • 100%)/22 = 41,82%.
w%(С₂H₅OH) = 100% — 41,82 = 58,18%.
Ответ: w%(СH₃OH) = 41,82% • w%(С₂H₅OH) = 58,18%.
Определение объемных долей метана и этана в смеси газов
Задача 190.На сжигание природного газа объемом 200 л, содержащего метан, этан и негорючие примеси, затратили кислород объемом 395 л. Объемы газов измерены при нормальных условиях. Определите объемные доли метана и этана в газе, если объемная доля негорючих примесей составляет 5%.Решение:
1. Расчет объемов метана и этана в горючей смеси
Уравнения реакции горения веществ будут иметь вид:
1) CH4 + 2O2 = CO2 + 2H2O2) C2H6 + 3,5O2 = 2CO2 + 3H2O
Рассчитаем обем чистой газовой смеси, получим:
V(смеси) — 200 • (1 -0,05) = 190 л.
Из уравнений горения газов вытекает, что на сгорание 1 моль метана затрачивается 2 моль кислорода, а на сгорание этана — 3,5 моль.
Примем объм метана и этана в газовой смеси за «х» и «у» соответственно, 2х и 3,5Y.
Для вычисления состава смеси метана и этана в обьемных частях составим уравнение с двумя паременными, плоучим:
х + y = 190х + 3,5у = 395
Решим систему линейных уравнений методом подстановки:
Выразим из первого уравнения х + у = 190 данной системы «y» через «x», получим:
у = (190 — х).
Подставив во второе уравнение х + 3,5у = 395 данной системы вместо «y» выражение (19 — х), получим систему:
х + у = 190х + 3,5(190 — х) = 395
Полученные системы равносильны. В последней системе второе уравнение содержит только одну переменную. Решим это уравнение, получим:
х + 3,5(190 — х) = 395х + 665 — 3,5х = 395″х» = 108
Тогда
«у» = 190 — «х» = 190 — 108 = 82.
V(CH4) = 108 л;
V(C2H6) = 82 л.
2. Расчет объемных долей метана и этана в газе
w%V(CH4) = [V(CH4) • 100%]/V(смеси) = (108 л • 100%)/190 л = 56,84%;w%V(C2H6) = [V(C2H6) • 100%]/V(смеси) = (82 л • 100%)/190 л = 43,16%.
Ответ: w%V(CH4) = 56,84%; w%V(C2H6) = 43,16% л.
Растворимость. Коэффициент растворимости
Растворение –
процесс образования раствора из компонентов. Растворение
представляет собой обратимый процесс, который при неизменности
внешних условий достигает состояния равновесия.
Раствор, находящийся в состоянии равновесия с
избытком растворенного вещества, называется
насыщенным.
Концентрация насыщенного
раствора – это равновесная концентрация, зависящая от природы
растворителя, растворенного вещества и не зависящая от того, как
раствор был приготовлен.
Способность
вещества растворяться в определенном растворителе называется
растворимостью этого вещества в данном растворителе.
Чаще всего характеризуют способность вещества
растворяться в воде и под растворимостью вещества понимают
растворимость в воде. Количесвенно растворимость вещества при
определенных условиях может быть связана с концентрацией его
насыщенного при данных условиях раствора, т.к. это –
воспроизводящаяся величина. Принятыми способами выражения
растворимости вещества в воде (или другом растворителе) является
коэффициент растворимости.
Коэффициент
растворимости показывает, какую массу вещества надо растворить
при определенных условиях в 100 г воды (или в 1 литре воды),
чтобы получить насыщенный при данных условиях раствор. При
записи коэффициента растворимости обязательно указывается
вещество, растворитель и внешние условия (для веществ в твердом
состоянии обычно в качестве внешних условий указывают только
температуру), например:
растворимость
KNO3при 20oС равна 25 г в 100 г воды,
или
растворимость KNO3 в воде
при 20oС равна 250 г/ л.
По
электропроводности растворов их делят на растворы электролитов –
эти растворы проводят электрический ток – и растворы
неэлектролитов, не обладающие электропроводностью.
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Получение объема раствора с молярной концентрацией эквивалента
Задача 188.
Какой объём раствора с молярной концентрацией эквивалента 2 моль/л можно получить из 0,6 кг раствора кальций нитрата с массовой долей соли 3,4% (р = 1,01 г/мл)?Дано:
w% = 3,4% или 0,034;
m(p-pa) = 0,6 кг или 600 г;
МЭ[Ca(NO3)2] = 82,044 г/моль;
CЭ[Ca(NO3)2] = 2 моль/л;
V(p-pa) = ?Решение:Эквивалент – это условная или реальная частица, которая в данной химической реакции эквивалентна одному атому или иону водорода, или одному протону, или одному электрону (по — другому, способна замещать или присоединять 1 грамм водорода).Эквивалент – есть 1/z часть частицы (молекулы, атома).
У соли Z равно произведению валентности (степени окисления) металла на число атомов металла. Например,
Z[Ca(NO3)2] = (+2) · 1 = 2.
Z для (Al2(SO4)3) = 3·2 = 6.
Так как М[Ca(NO3)2] = 164,088 г/моль, то молярная масса эквивалента нитрата кальция равна молярной массе соли поделенной на влентность кильция, получим:
МЭ[Ca(NO3)2] = 164,088/2 = 82,044 г/моль.
Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревшее) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль/л:
CЭ(B) = m(В)/[МЭ(B) • V(p-pa), где
MЭ – молярная масса эквивалента, m(В) — масса вещества в растворе, V(p-pa) — объем раствора вещества.
Отсюда
CЭ[Ca(NO3)2] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • V(p-pa).
Закон эквивалентов для индивидуальных веществ, например для раствора Ca(NO3)2 записывается так:
m(B)/МЭ(В) = [CЭ(B) • V(p-pa)] или m[Ca(NO3)2]/МЭ[Ca(NO3)2] = {[Ca(NO3)2] • V(p-pa).
Отсюда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]}.
Для решения задачи необходимо найти массу нитрата кальция в растворе, получим:
m[Ca(NO3)2] = w% • m(p-pa) = 0,034 • 600 = 20,4 г.
Тогда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]} = 20,4 г/82,044 г/моль • 2 моль/л = 0,124 л или 124 мл.
Ответ: 124 мл.
Решение задачи можно представить так:
m[Ca(NO3)2] = w% • m(p-pa) = 0,034 • (600 • 1,01) = 20,604 г.
Тогда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]} = 20,604 г/82,044 г/моль • 2 моль/л = 0,1256 л или 125,6 мл.
Ответ: 125,6 мл.
Состав парфюмерии
Любой парфюмерный продукт имеет определенный состав, главным компонентом которого является «действующее вещество». От его количества в основном зависит стойкость духов. Такими элементами могут быть компоненты растительного или животного происхождения. Разница заключается не только в способах их добычи, но и в крепости и устойчивости: последние сильнее и более сильными.
Растительные – добываются из лепестков цветов, кореньев, коры. Несмотря на то что они немного слабее, применяются чаще, чем животные продукты из гуманных соображений. Самыми популярными представителями флоры, использующимися парфюмерами, являются:
- сандал;
- роза;
- апельсиновые, персиковые, ирисовые цветы;
- цитрусовые;
- пачули;
- ветивер.
Отдельно стоит выделить жасминовые ноты, так как этот цветок является источником одного очень необычного элемента – индола. Индольность в парфюмерии – это тонкие сладкие нотки, пробуждающие в человеке животные инстинкты. Именно такие аккорды добавляют, чтобы придать аромату ауру соблазна и сексуальности. Хотя нужно отметить, что индол настолько привлекателен лишь в обработанном и в разбавленном состоянии. Сам по себе он имеет очень специфический, напоминающий отходы запах.
Элементы животного происхождения крайне дорогие. Их используют для закрепления и стойкости парфюмерной композиции. Но многие из них запрещено добывать, поэтому их парфюмеры заменяют синтетикой.
Среди подобных компонентов очень популярными являются:
- Амбра – наиболее дорогой ингредиент, который добывают из кишечника кашалота. Сегодня его добыча посредством отлова этих млекопитающих запрещена. Однако в парфюмерии могут использоваться фрагменты, выброшенные морем на берег.
- Мускус – без обработки имеет довольно специфический аммиачный запах. Но после спиртовой переработки он приобретает яркую чувственную, ни с чем не сравнимую ноту, способную украсить любой аромат. Он выделяется железами семейства косуль – кабарги. Еще совсем недавно, чтобы заполучить этот компонент, зверей приходилось убивать. Их поголовье начало значительно уменьшаться стремительными темпами. Поэтому был введен строгий запрет на их отлов и истребление. Мускус научились добывать более гуманным способом. В последнее время парфюмерами все чаще применяются синтетические схожие ингредиенты вместо природного.
- Кастореум – считается одним из наиболее ценных элементов, использующихся при создании парфюмерного продукта. Вещество выделяется железами бобра (его еще называют «бобровая струя»). Звучит, конечно, непривлекательно, однако это лучший фиксатор ароматической композиции.
Также в состав парфюма добавляют спирт, эфирные масла, растворитель, краситель. Специалисты могут применять синтетические добавки, чтобы заменить сложные натуральные компоненты. Такой материал изготавливают в специальных лабораториях.
Таблица ниже демонстрирует концентрацию ароматических веществ в духах, маркировку парфюмерии и спиртовые содержания в туалетной воде.
|
Наименование |
Душистые аромавещества |
Маркирование |
Насыщенность спирта |
|
Одеколон |
В Европе – 3-5% В США – 12-15% |
EDC |
70% |
|
Туалетная вода |
4-10% |
EDT |
85% |
|
Парфюмерная вода |
10-20% |
EDP |
90% |
|
Духи |
25-30% |
PARF |
90% |
Формула любой из описанных разновидностей расписывается в форме треугольника, который принято называть ольфакторной пирамидой. Композиция строится на 3 нотах: начальной, средней (сердце) и базисной. Первые проявляются и полностью начинают ощущаться уже через 15 минут после нанесения парфюма. Затем начинают играть сердечные нотки. Финальным аккордом является база, которая, как правило, обеспечивает силу, стойкость и шлейф.
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.

* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P . Тогда:
(I)
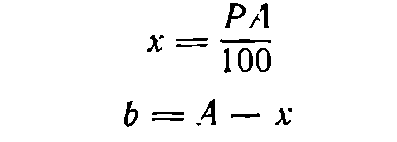
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
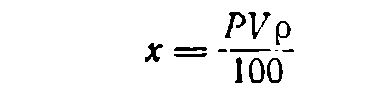
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
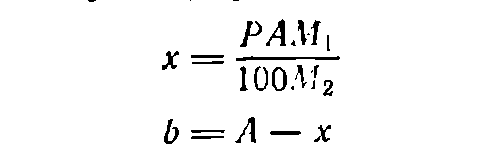
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
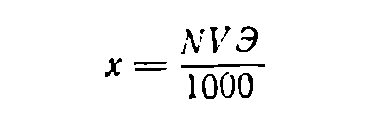
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
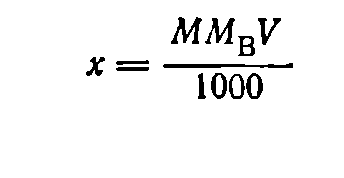
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(9)
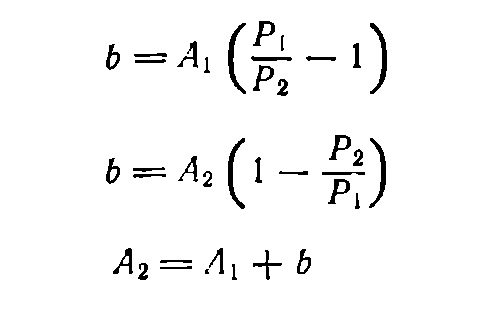
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 , а концентрация исходного раствора равна P1 , то объем исходного раствора вычисляется по формуле:
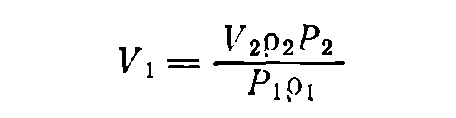
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
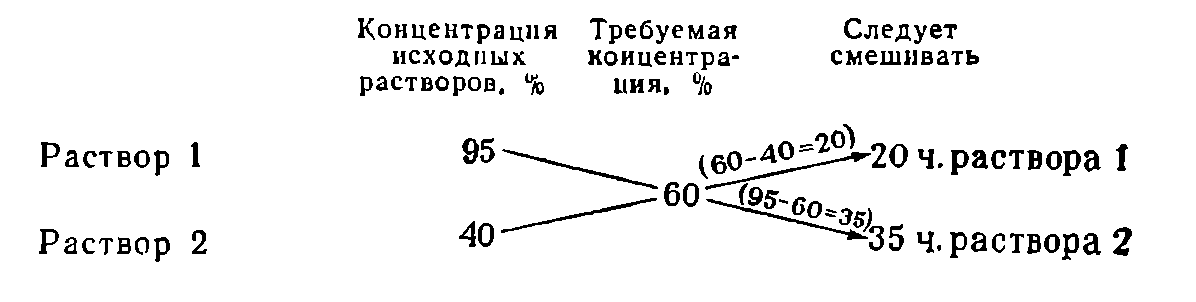
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:

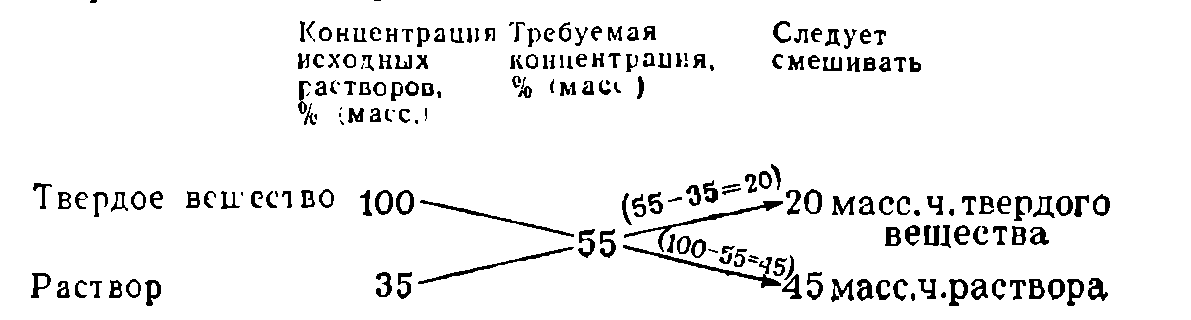
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
ПРИЛОЖЕНИЕ 1 (обязательное)
ПРИЛОЖЕНИЕ 1ОбязательноеТаблица 1
Приведение объемов титрованных растворов при данной температуре к объемам при 20 °С (для 1000 см)
|
Температура, °C |
Вода, растворы молярной концентрации 0,01 моль/дм |
Растворы молярной концентрации |
||||
|
0,1 моль/дм (кроме ) |
0,5 моль/дм |
1 моль/дм |
0,5 моль/дм |
1 моль/дм |
||
|
5 |
+1,5 |
+1,7 |
+1,9 |
+2,3 |
+2,35 |
+3,6 |
|
6 |
+1,5 |
+1,65 |
+1,85 |
+2,2 |
+2,25 |
+3,4 |
|
7 |
+1,4 |
+1,6 |
+1,8 |
+2,15 |
+2,2 |
+3,2 |
|
8 |
+1,4 |
+1,55 |
+1,75 |
+2,1 |
+2,15 |
+3,0 |
|
9 |
+1,4 |
+1,5 |
+1,7 |
+2,0 |
+2,05 |
+2,7 |
|
10 |
+1,3 |
+1,45 |
+1,6 |
+1,9 |
+1,95 |
+2,5 |
|
11 |
+1,2 |
+1,35 |
+1,5 |
+1,8 |
+1,8 |
+2,3 |
|
12 |
+1,1 |
+1,3 |
+1,4 |
+1,6 |
+1,7 |
+2,0 |
|
13 |
+1,0 |
+1,1 |
+1,2 |
+1,4 |
+1,5 |
+1,8 |
|
14 |
+0,9 |
+1,0 |
+1,1 |
+1,2 |
+1,3 |
+1,6 |
|
15 |
+0,8 |
+0,9 |
+0,9 |
+1,0 |
+1,1 |
+1,3 |
|
16 |
+0,6 |
+0,7 |
+0,8 |
+0,8 |
+0,9 |
+1,1 |
|
17 |
+0,5 |
+0,6 |
+0,6 |
+0,6 |
+0,7 |
+0,8 |
|
18 |
+0,3 |
+0,4 |
+0,4 |
+0,4 |
+0,5 |
+0,6 |
|
19 |
+0,2 |
+0,2 |
+0,2 |
+0,2 |
+0,2 |
+0,3 |
|
20 |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
0,0 |
|
21 |
-0,2 |
-0,2 |
-0,2 |
-0,2 |
-0,2 |
-0,3 |
|
22 |
-0,4 |
-0,4 |
-0,4 |
-0,5 |
-0,5 |
-0,6 |
|
23 |
-0,6 |
-0,6 |
-0,7 |
-0,7 |
-0,8 |
-0,9 |
|
24 |
-0,8 |
-0,9 |
-0,9 |
-1,0 |
-1,0 |
-1,2 |
|
25 |
-1,0 |
-1,1 |
-1,1 |
-1,2 |
-1,3 |
-1,5 |
|
26 |
-1,3 |
-1,4 |
-1,4 |
-1,4 |
-1,5 |
-1,8 |
|
27 |
-1,5 |
-1,7 |
-1,7 |
-1,7 |
-1,8 |
-2,1 |
|
28 |
-1,8 |
-2,0 |
-2,0 |
-2,0 |
-2,1 |
-2,4 |
|
29 |
-2,1 |
-2,3 |
-2,3 |
-2,3 |
-2,4 |
-2,8 |
|
30 |
-2,3 |
-2,5 |
-2,5 |
-2,6 |
-2,8 |
-3,2 |
Числа в графах 2-7 выражают объемы в кубических сантиметрах, которые следует прибавить (+) к 1000 см соответствующей жидкости при °С или вычесть (-) от 1000 см, чтобы получить объем титрованного раствора при 20 °С.Примеры
1. В колбу вместимостью 1 дм, калиброванную при 20 °C, необходимо налить при 15 °C раствор азотнокислого серебра 0,1 моль/дм. По табл.1 находим, что при 20 °C этот раствор займет объем больший на 0,9 см.
2. Из бюретки, калиброванной при 20 °С, при 25 °C израсходовано на титрование 34,75 см раствора гидроокиси натрия концентрации 1 моль/дм. При 20 °С расход реактива будет следующий:
см.
Таблица 2
Поправка объемов разбавленных растворов при разных температурах
|
Температура, °C |
Объем, см |
|||||
|
10 |
20 |
25 |
30 |
40 |
50 |
|
|
Поправка |
||||||
|
10 |
+0,01 |
+0,03 |
+0,03 |
+0,04 |
+0,05 |
+0,06 |
|
12 |
+0,01 |
+0,02 |
+0,03 |
+0,03 |
+0,04 |
+0,06 |
|
14 |
+0,01 |
+0,02 |
+0,02 |
+0,03 |
+0,04 |
+0,05 |
|
16 |
+0,01 |
+0,01 |
+0,02 |
+0,02 |
+0,03 |
+0,03 |
|
18 |
0,00 |
+0,01 |
+0,01 |
+0,01 |
+0,01 |
+0,02 |
|
20 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
|
22 |
0,00 |
-0,01 |
-0,01 |
-0,01 |
-0,02 |
-0,02 |
|
24 |
-0,01 |
-0,02 |
-0,02 |
-0,02 |
-0,03 |
-0,04 |
|
26 |
-0,01 |
-0,03 |
-0,03 |
-0,04 |
-0,05 |
-0,06 |
|
28 |
-0,02 |
-0,03 |
-0,04 |
-0,05 |
-0,07 |
-0,09 |
|
30 |
-0,02 |
-0,03 |
-0,05 |
-0,07 |
-0,09 |
-0,12 |
Табл.2 пользуются при работе с растворами концентрации 0,1 моль/дм или более разбавленными. ПРИЛОЖЕНИЕ 1. (Измененная редакция, Изм. N 1).
Eau de cologne
Немногие в курсе того, что одеколон EDC также имеет название «кельнинская вода» (в переводе с французского). В действительности это изделие, созданное парфюмером из Италии Йоганном Марией Фарина в далеком 1709-м. Предприятие по созданию духов, основанное им, находилось в городе Кельн. В честь этого места Фарина и решил назвать свое творение.
Со временем одеколоном стали называть любую туалетную или парфюмированную продукцию с легким запахом, где содержание алкоголя доходит до 70%, а наличие ароматических компонентов – всего 2-5%. Позже cologne было принято считать любой дешевый пахучий продукт с повышенным содержанием алкоголя и низким процентажем ароматических веществ.
